(一)材料与方法
人T淋巴细胞株Jurkat(医科院基础所免疫系),进行传代培养,在对数生长期,将细胞打起,取2ml细胞悬液,加至50ml离心管中,再加1ml15%FCS RPMI1640培养液,旋涡振荡,在离心管中补加19ml 15%FCS RPMI1640培养液,将上述22mlJurkat细胞悬液均匀分配至三块6孔板(CORNING)中,每孔补加4ml 15%FCS RPMI1640培养液。注意此时要对数量相同的Jurkat细胞进行荧光读数检测(作为实验前荧光读数值,方法见下)。培养5小时后,细胞沉淀到底部,加药。三块Jurkat细胞培养板,第一块板用于大剂量试验,上三孔加10块再生物质,第二块板用于中剂量试验,上三孔加6块再生物质,第三块板用于小剂量试验,上三孔加3块再生物质,三块板的下三孔为对照孔,均加入RPMI1640培养液。培养并适时换液,在培养第7天,进行下列项目的检测:
1、观察培养孔中细胞密度的改变,以检测细胞增殖的程度;
2、在高倍和低倍镜下观察细胞孔中央密度;
3、比较实验孔和对照孔细胞中央密度,同时比较培养孔周边细胞密度;
4、观察实验组和对照组细胞的镜下形态;
5、实验组和对照组细胞用苏木精-伊红染色;
步骤如下:(1)预先配制好染色用全套试剂,并将蛋清/甘油粘片剂涂于洁净载玻片上,吹风机吹干;(2)在培养Jurkat细胞的6孔培养板中,取一个实验孔和一个对照孔,去掉实验孔中的再生物质;(3)从实验组和对照组的培养孔中各吸出3ml上清,剩约1ml;(4)用微量加样器吹打底部之细胞,制成细胞悬液;(5)将实验组和对照组的细胞悬液分别吸至不同的2ml离心管中;(6)水平转头离心,2000转/分钟,离心5分钟,弃上清,留约10ul;(7)混悬细胞,制成细胞悬液;(8)将上述制备好的微量细胞悬液,加至载玻片上,用希耳球吹匀平摊;(9)干燥至无水分为止;(10)染色过程:10%甲醛固定10分钟,水洗;苏木精染色2分钟,水洗30秒;1%盐酸酒精分化20秒,自来水洗20秒;稀氨水30秒,自来水洗20秒;伊红染色1分钟,水洗10秒;85%酒精20秒;90%酒精30秒;95%酒精1分钟;无水乙醇Ⅰ1分钟;无水乙醇Ⅱ2分钟;二甲苯Ⅰ1分钟;二甲苯Ⅱ1分钟;中性树胶盖玻片封固;37℃烤干。
6、实验组和对照组培养孔上清酸碱度比较;
7、检测经过培养的实验组和对照组细胞的荧光值,以判断细胞增殖的程度;具体方法如下:(1)在培养Jurkat细胞的6孔培养板中,去掉实验孔中的再生物质;(2)从实验组和对照组的培养孔中各吸出3ml上清,移至小瓶中,比较酸碱度,切勿扰底部之细胞,此时剩约1ml;(3)用微量加样器吹打底部之细胞,制成细胞悬液;(4)将实验组和对照组的细胞悬液分别吸至不同的2ml离心管中;(5)水平转头离心,2000转/分钟,离心5分钟,照相比较细胞团块的大小以比较细胞数目的多少,吸弃干净上清;(6)加20μl吖啶橙基液,再加1mlPBS;(7)振荡混匀,5分钟;(8)离心,条件同上;(9)弃净上清,每孔加100μlPBS,混匀;(10)将各孔的细胞悬液加至96孔LABSYSTEMS CLINIPLATE标准检测板中,至此有三个实验孔,三个对照孔,另设三个PBS空白对照孔;(11)用荧光/化学发光仪检测荧光,条件为激发光波长485nm,发射光波长527nm,检测值与DNA量成正比,间接反映细胞数量。
(二)结果
 |
 |
| 1A (×100) |
1B(×400) |
图1 三个剂量培养板中加药前实验组和对照组培养孔中央细胞密度和周边密度的比较。1A显示中央密度,1B显示周边密度,由于向心性生长之故,中央密度明显比周边密度高,Jurkat细胞生长正常,圆形透明。 |
表1 为荧光读数结果统计表。统计结果表明,三个剂量各自的实验组和对照组差异极为显著(P<0.01),三个剂量的实验组无差异(P>0.05),三个剂量的对照组也无差异(P>0.05),三个剂量的实验组与实验前检测值无差异(P>0.05),三个剂量的对照组与实验前检测值有显著差异(P<0.01)。
表1 检测结果统计 |
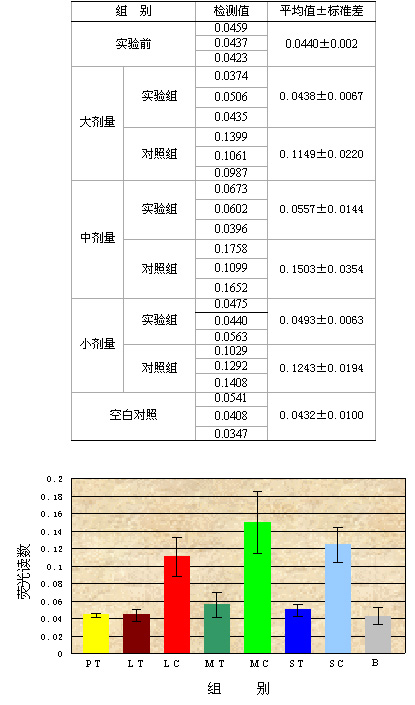 |
图8 为表1的统计结果直方图。图中可见不同剂量之间,实验组和对照组之间的对比关系。PT:实验前检测值;LT:大剂量实验组;LC:大剂量对照组;MT:中剂量实验组;MC:中剂量对照组;ST:小剂量实验组;SC:小剂量对照组;B:空白对照组 |
|
