- 对MEBO抗炎及解毒作用的初步研究

-
目录
- 英文文摘
- 1989~1997年《中国烧伤创疡杂志》引文分析
- 烧伤湿性医疗技术部分技术要点解析
- 背阔肌肌皮瓣修复深度电损伤创面
- 网状皮肤移植术在大面积烧伤关节肉芽创面上的应用
- 早期切开引流MEBO纱布换药治疗软组织挤压伤
- MEBO纱条鼻腔填塞治疗鼻出血59例报告
- MEBO治疗双小腿严重广泛化脓性溃疡体会
- 应用MEBO包扎治疗皮肤深度慢性溃疡
- MEBO在宫颈糜烂电灼术后的应用
- 美宝止痒霜止痒疗效评价(附114例病例报告)
- 美比欧疤痕平治疗增生性疤痕35例临床体会
- 高频喷射通气救治烧伤并发ARDS的体会
- 体外循环手术中电烧伤治疗(附12例临床报告)
- MEBT治疗烧伤病人588例临床经验与体会
- 湿润暴露疗法治疗烧烫伤28例体会
- MEBO治疗婴幼儿烫伤225例报告
- MEBO治疗大面积重度特重度烧伤67例
- MEBT配合肉芽创面微粒皮种植治疗深Ⅲ度烧伤
- MEBO治疗15例大面积烧伤病人的临床体会
- 对111例3岁以下幼儿烧(烫)伤使用MEBO疗法临床病例分析
- MEBT防治烧伤休克临床应用及实验研究
- 美宝皮康霜临床验证报告
- 烧伤后多器官功能衰竭84例分析
- 肾功能放免联检在严重烧伤的应用
- 烧伤金黄色葡萄球菌败血症(附179例分析)
- 对MEBO抗炎及解毒作用的初步研究
- 人真皮乳头血管球的形态学及其临床意义
- 中国烧伤创疡科技医疗中心的合格验收条件
- 全国烧伤创疡科技中心工作会议在京召开
- 首届中西医结合大会暨烧伤卫星会议在京胜利召开
A PRELIMINARY RESEARCH ON THE ANTIINFLAMMATORY AND DETOXIFYING EFFECTS OF MEBO
山东莱芜市第二人民医院(271100)
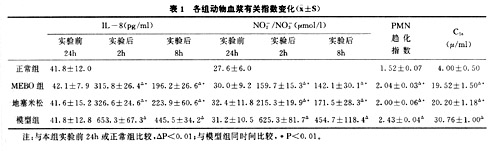
黄庆山 李开贤 朱丹青〔内容摘要〕 本实验采用内毒素所致家兔弥漫性血管内凝血(DIC)模型,测定外周血白介素 8(IL-8)、亚硝酸根/硝酸离子(NO-2/NO-3)水平,补体C5a活性及中性粒细胞(PMN)趋 化指数,并观察MEBO对上述指标的影响。结果表明:模型组血浆IL-8、NO-2/NO-3水平及 C5a活性和PMN趋化指数均显著升高,其升高水平和组织、器官的损害程度相一致。MEBO 及地塞米松治疗组上述指标均显著降低(P<0.01),病理组织学改变亦轻。提示:IL-8、一氧化氮(NO)参与DIC发病过程,MEBO抑制炎症反应,防止DIC的作用机理部分是通过调控 细胞因子网络而实现的。
关键词:MEBO 抗炎 解毒 IL-8 CO DIC 补体
白介素8(IL-8)和一氧化氮(NO)是体内重要的细胞因子,不仅参与机体的免疫调节及防御反应,还具有强烈的致炎活性, 介导内毒素(LPS)的致伤作用。本实验采用间隔24h两次注射LPS诱发家兔全身性施瓦茨曼hwartzman)反应,制作DIC模型,测定血浆IL-8、亚硝酸根离子(NO-2/NO-3)含量,观 察补体C5a活性及中性粒细胞(PMN)趋化指数变化。旨在探讨IL-8、NO在内毒素性弥漫性 血管内凝血(DIC)中的作用及MEBO对其病理作用的拮抗效应。从而进一步证实MEBO的抗炎、 解毒及免疫双向调节作用[1]。材料与方法
一、材料
1.动物 健康大耳白兔32只,雌雄各半,体重1.5~2.5kg,月龄2.5~3月,由本院医学实验动物室提供。
2.药物及试剂主要药物 MEBO(主要成分为黄柏内脂,β-谷甾醇,由北京光明中医烧伤创疡研究所提供)。和地塞米松磷酸钠注射液(5mg/ml)。主要试剂:冻干精制E,Colicin B4内毒素(1mg/支)。IL-8标准检测盒。3,5,3′,5′四甲基联苯胺(TMB)。酵母多糖。Percoll白细胞分层液。
3.仪器 国产GL-20B型高速冷冻离心机,国产DG-3022A型酶联检测仪。96孔PVC板。721型单光束分光光度计。
二、方法
1.动物模型建立和分组 将32只家兔随机分为4组,每组8只。①模型组:正常饲料喂养,每日三次。从家兔耳缘静脉间隔24h两次注射LPS,用量分别为15mg/kg、35mg/kg体重。第1次注射LPS后立即注射生理盐水(NS)5mg/kg体重,以后每12h注射1次,共3次。②MEBO组:试验前24h及试验中用MEBO 40g加入正常饲料100g混合比例喂养。每日4次。同时LPS给予方法及用量同模型组。③地塞米松组:LPS和NS给予方法及用量同模型组,在注射NS同时,每次经静脉给予地塞米松1ml/kg体重。④正常对照组:仅如模型组注射等量NS。
2.标本制备 根据预备实验DIC模型家兔IL-8高峰出现在每次注射LPS后2h,而第2次注射LPS后8h尚维持较高水平,明显高于基础值41.83±12.04pg/ml,故各组动物于-实验前24h及第2次注射内毒素后2h、8h,经兔耳中央动脉取血,作如下处理:①4℃低温分离血浆,分装冻存于-30℃待检。②沉降红细胞后,取上清液进行密度梯度离心。经Hanks液洗涤的细胞用RPMI-1640配成PMN悬液,分为2份,分别用于补体C5a活性及PMN趋化性测定,浓度分别为5×107/ml、2.5×107/ml,台盼蓝染色,测定细胞成活率(95.6±0.5)%,PMN纯度(95.2±0.9)%。③补体激活血浆及趋化因子制备:分离的血浆中加入经调理的酵母多糖(OPZ),温育后离心取上清,4℃下保存作PMN激活物用,另取4只健康兔耳静脉血2ml混合凝固后离心取上清,冻存于-30℃ 24h作趋化因子用。
3.检测方法 ①IL-8采用夹心ELISA法,具体操作步骤按试剂盒说明书。包被抗IL-8单抗的PVC板,室温孵育后,各孔分别加入不同浓度的标准品及血浆样品,室温孵育、洗涤 后加抗IL-8生物素结合物、孵育、洗涤后加链霉亲合素-HRP(辣根过氧化物酶)结合物、孵育、 洗涤后加TMB/H2O2底物缓冲液反应显色,用1.8mmol/LH2SO4终止反应后,于酶联仪450n m处读数,根据标准曲线计算样品中IL-8含量。②PMN趋化性测定:琼脂糖玻片法[2]。 ③NO-2/NO-3测定:镉还原柱层析和比色法[3]。④补体C5a活性测定:用C5a介导的中性粒细胞凝集法[4]。
结果与分析
1.血浆IL-8、NO-2/NO-3、PMN趋化指数、血浆C5a活性变化结果汇于表1中。除 正常组外,其他3组动物血浆IL-8、NO-2/NO-3水平、PMN趋化指数和血浆C5a活性与实 验前比较均有不同程度的升高,以模型组最为显著,与两治疗组比较有显著性差异(P<0.01)。 相关分析表明,模型组IL-8与NO-2/NO-3水平呈正相关(P<0.01)。
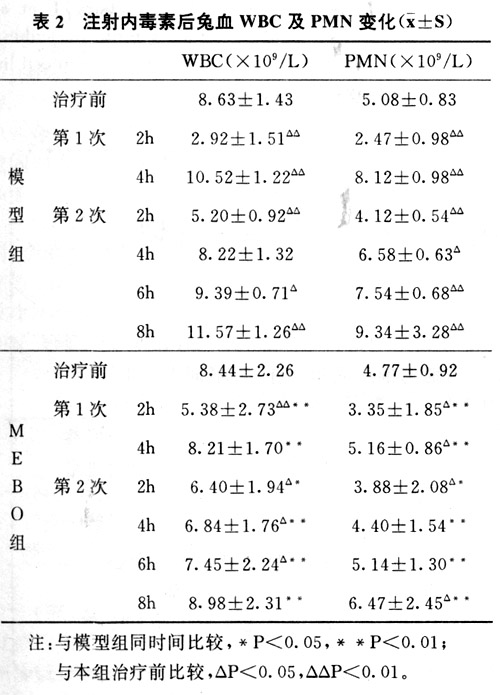
2.兔血WBC及PMN计数的动态变化结果汇于表2中。两次注射LPS后2h,血WBC总数和 PMN数目均下降,此后持续回升;而MEBO组下降幅度小。模型组外周血WBC和PMN计数 变化与血浆IL-8水平呈高度负相关(P<0.01);与血浆C5a活性变化亦呈高度负相关(P< 0.01)。
讨 论
机体受炎性因子刺激后会发生炎性反应。中医的解毒,既是解除入侵细菌病原微生物之“外 毒”,又是解除内毒素及其诱生的炎症介质和细胞因子之“内毒”,是“祛邪”及“抗炎”的概 括。水肿、疼痛是烧伤局部的主要炎性反应特征。烧伤后由于局部血液微循环受到破坏,血 氧环境的改变及组织细胞的代谢障碍,血流会产生瘀滞状态,血不行则肿痛。我们以往的研 究证实[5],MEBO可通过活血化瘀作用,疏通或改善局部代谢紊乱,起到消肿、止痛及促 进创面愈合的目的。但是活血化瘀不等于抗炎,它只能消除其反应,不能完全消除烧伤后机 体炎性因子及毒素产生。为此,本课题进行了MEBO抗炎作用的研究。我们在另一研究中还证 实[1],MEBO具有免疫双向调节作用,并通过提高机体免疫功能,对抗细菌、毒素的侵袭, 达到抗感染的目的。MEBO是否诱发免疫调节反应是本次研究的目的之一。结果证实,MEBO在产生上述作用的同时,还具有阻止机体产生炎性因子,减轻局部炎性反应等,抗炎作用。
IL-8主要是由单核细胞、组织巨噬细胞、PMN、血管内皮细胞在LPS等刺激下所产生的 多源性细胞因子,也是目前已知的最强的PMN趋化和激活因子[6]。IL-8能诱导细胞变形 反应,脱颗粒反应,呼吸爆发及释放蛋白酶、溶酶体类和氧自由基,促进内皮或非内皮源性 左旋精氨酸1-氧化氮(L-Arg/NO)途径刺激产生NO。有资料表明,IL-8可介导白介素I(IL-1)在体内的炎症效应,能引起与内毒素血症、烧伤后感染休克类似的病理生理反应,其参 与DIC发生的可能机制:趋化和过度激活粒细胞,释放大量毒性产物及炎症介质,激活凝血、 纤溶、激肽系统,最终导致内皮损伤及微血管血栓形成[7]。近年来研究认为,NO在烧伤、 感染性休克发病机制中起重要作用。在单核、巨噬细胞的诱导型NO合成酶(iNOS)在LPS和T NF,IL-1等细胞因子刺激下,持续大量产生NO,可导致血管持续舒张,血压降低,组织灌 注异常,乃至休克,并可损伤血管内皮细胞,导致DIC发生[8]。我们的研究证实,MEB O具有调控烧伤后超氧化物歧化酶及脂质过氧化作用,清除氧自由基,防治炎性介导损害亦与 此有关[9]。本实验发现,内毒素性DIC家兔模型中循环血IL-8、NO-2/NO-3水平均较正 常对照组显著升高,IL-8与NO-2/NO-3水平呈高度正相关,表明两者协同参与了DIC的发病机制。
本实验还证实,在烧伤早期外周血白细胞计数有短暂下降,而C5a活性及PMN趋化指数
却明显增高,白细胞计数变化与IL-8水平呈高度负相关,与血浆C5a活性变化亦呈明显负 相关关系。MEBO在降低IL-8、NO-2/NO-3水平及C5a活性的同时,也减轻了WBC浸润及 脏器组织的病理改变。因此,可认为,MEBO能调控上述指标水平,并部分拮抗其病理效应。 地塞米松抑制细胞因子诱导iNOS,且能直接抑制iNOS的表达;在转录水平可抑制IL-8的 产生,并可取消IL-8诱导的白细胞游走[10]。本实验发现,MEBO具有同地塞米松相似 的效果,提示MEBO与地塞米松对细胞因子的作用类似。也有可能是通过抑制其合成、中和其 作用或阻断其效应,使其恢复至接近正常细胞因子的网络水平,终止所介导的炎症反应,达到防治内毒素性DIC之目的。其机理有待于进一步探讨。参 考 文 献
[1]黄庆山等。MEBO对烧伤患者的免疫学影响。中国烧伤创疡杂志,1997;1:6
[2]张克坚。琼脂糖法白细胞趋化实验。中国医科大学学报,1984;13(4):70
[3]Hegesh E, Shjloah J.Blood nitrates and infantile methemoglobinem
ia. Clin Chin Acta 1982;125(2):107
[4]王士雯等,过敏毒素C5a与老年多器官衰竭(MOF),免疫学杂志,1989;5(3):2
09
[5]黄庆山等,对MEBO活血化瘀初步的微观研究,中国烧伤创疡杂志,1997;2:3
[6]Hack CE, Hartm, Vanschijndel RJMS, etal. Interleukin_8 in Sepsis;
relation Shock and inflatory mediators. Infection Immunity 1992; 60(7)
:2835
[7]Deitch EA. Multiple organ failure: path_ophysiology and potenti
al future therapy. Am surg 1992; 216(2):117
[8]Moncada S, Palmer RMJ, Higgs EA.Nitrie oxide:physiolgy, pathophy
siology, and pharmacology. Pharmacol Rev 1991; 43(2):109
[9]黄庆山,MEBO对实验性电光性眼炎角膜超氧化物歧化酶和过氧化脂质的影响及临床观察,
1996;4:51
[10]Mukaida N, Gussella GL, Kasahara T et al. Molecular analysis of th
e inhibition of interleukin-8 production by dexamethasone in a human c
ell line Immunology, 1992; 75:674