- 烧伤监护与临床处理第四讲 血气指标对酸碱平衡的考核(上)

-
目录
- 英文摘要
- 论烧伤创面治疗原则
- 烧伤监护与临床处理第四讲 血气指标对酸碱平衡的考核(上)
- 介绍一种多功能测量体温盒
- 烧伤病房物品表面的细菌测定
- 烧伤疤痕头皮角一例报告
- 应用超薄皮瓣修复手外伤皮肤缺损及手瘢痕挛缩畸形
- 手指侧方逆行岛状皮瓣修复指端软组织缺损
- 改良软组织扩张法治疗26例疤痕性秃发
- 脐膀皮瓣在上肢高压电烧伤中的应用 (附7例报告)
- MEBO在手外伤后创面长期不愈的应用
- MEBO与PIC联合治疗单纯疱疹性角膜溃疡25例临床观察(附30例对照)
- MEBO治疗带状疱疹30例临床疗效观察
- 应用MEBO治疗鼻前庭炎46例报告
- 湿润暴露疗法治疗烧伤围休克期的治疗
- 烧伤湿性疗法抗休克临床经验体会
- 湿干性疗法对照治疗功能部位烧伤
- MEBO在194例面、会阴、臀部烧伤中的应用体会
- 浅谈湿润烧伤膏作用机理的微观学说
- 浅析烧伤医学三大要素——烧伤预防、治疗、康复
- 美国专家对中国湿润烧伤膏及烧伤湿润暴露疗法的剖析评论
- 徐荣祥创烧伤湿润暴露疗法——全美烧伤受难者基金会主席来京向徐教授颁奖
(中国人民解放军139医院、鲁北烧伤中心张向清)
酸碱平衡的生理变化在医学领域的各个科系中,尤其是像严重烧伤这样的危重病人中是一个非常重要的课题。大面积烧伤病人经常发生酸碱平衡紊乱,常由于原发病的严重性,或并发了内脏并发病,使得典型的酸碱失衡症状变的错综复杂,给临床监护诊断带来困难。因此,要求监护室的医生们不但要认识原发病的基本处理方法,还应同酸碱平衡与平衡失调的基本矛盾结合起来统盘考虑,以便制定更有效的治疗措施。
亨德森---上哈塞尔巴赫方程是考核酸碱平衡与定量治疗的基础
(一)亨一哈方程的含义及重要性
亨一哈方程是说明血液中碳酸与碳酸氢盐系统的比例与细胞外液PH之间内在关联的程式。早在1909年由Henderson首先进行研究,后来于1916年Hasselbach加以改进,即成为今天大家熟知的Henderson-Hasselbach方程式。
式中少a系碳酸在37℃标准气压时的离解常数,为6.1。过去认为,二氧化碳(CO2)遇水即成为H2CO3,后来发现CO2在溶液中呈H2CO3者其量甚微,绝大部分呈物理溶解状态。故以a·PCO2代替[H2CO3」更符合于实际。目前通用公式为:
式中a是CO2溶解系数,即在每毫米汞柱(0.133kpa)CO2分压下,一升血浆中CO2溶解量为 0.66ml.如将毫升换算为毫克分子,则为0.66/22.2=0.0301,故a=0.03。正常动脉血液中[HCO3-]为24mmol/L,而PaCO2为40mmHg( 5.33kpa), a·PC已为40X0.0301=1.2(mmol).
将以上数值代入亨一哈方程,则得:
由此可见,亨一哈方程的重要性在于它显示出血液PH取决于血液中「HCO3-」与a·PCO2的比值。不论哪个发生什么变化,只要它们的比值保持2O:1,pH即能保持在人4O正常范围内。这就揭示了临床上为什么有的病例存在代谢性酸、碱紊乱,或呼吸性酸碱紊乱,却没有酸血症或碱血症的实际情况。
(二)体内酸碱的正常代谢
正常人细胞外液的PH在7.35~7.45之间。要弄清这个问题需要复习一下体内酸性与碱性物质的来源。体内酸性物质来源于糖、脂肪、蛋白质等中间或终末代谢产物。按其稳定性来分,又可分为挥发酸和固定酸。挥发酸主要是碳酸,由终末代谢产物CO2,衍生而来,即CO2 + H2O=H2O3.正常成人平均每天可产生CO2300~400升左右,如果全部生成H2CO3,折算成H+的数量约为15克分子。因H2CO3可通过呼吸作用排出体外,故得名挥发酸。磷酸、硫酸、酮体等因不能变成气体,故称之固定酸,而经肾脏排出。每天固定酸产生的数量约为50~90毫克分子。体内碱性物质主要来自蔬菜和水果,因其中含有大量有机酸的钠盐与钾盐,这些有机盐在体内氧化分解成为有机酸根和钠、钾盐。有机酸根可与H+结合变成有机酸进行氧化,而钠钾离子进入体液,导致碳酸氢离子增加。因此,蔬菜、
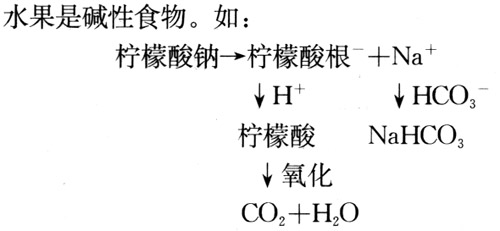
(三)酸碱平衡的防御系统
根据上述酸碱来源分析,体内酸的来源多于碱的来源。在酸碱平衡这对矛盾中,酸的产量过多是矛盾的主要方面。因此。临床上酸中毒的情况多于碱中毒。但是体内有一套“对付”酸性产物的防御系统,使酸碱平衡稳定在一个相对的平衡状态中。它们是:
1、缓冲系统,主要是碳酸氢盐——碳酸系统、 磷酸盐系统、蛋白质系统和血红蛋白系统。其中前者是最主要的,它与后三者联合起来发挥巨大的缓冲作用。缓冲系统可视为化学海绵,能在一秒钟内通过吸收或释放氧离子方式防止氢离子浓度发生过度变化。以碳酸氢盐——碳酸系统为例,因为碳酸是一种弱酸,它的离解度比其它酸低,在溶液中大部分碳酸解离为二氧化碳和水。其结果是,既有高浓度的可溶性CO2,又有低浓度的酸。碳酸氢盐在溶液中水解产生羟离子,使溶液中的碱度升高。
2、呼吸系统,体内CO2是由细胞内不同的代谢过程连续产生的。CO2从细胞内弥散到组织间液,然后进入血液循环,运送到肺脏,弥散至肺泡呼出。如果代谢产生的CO2速度增加,则细胞外液中的CO2浓度也增加;如果肺通气加快,则CO2的排出速度也随之加快,细胞外液中脱队积贮量则减少。相反,如此时呼吸速率减慢,则细沙液中的CO2含量就增加。因为呼吸中枢有对氢离子浓度反应的能力,这是氢离子对延髓呼吸中枢直接作用的 结果。又因呼吸通气量的改变,反过来改变体液的氢离于浓度,所以,呼吸系统是调节氢离子的反馈系统。酸中毒时,细胞外液的氢离子浓度增加,呼吸系统变得更为活跃(呼吸速率和深度增加),排出更多的CO2。由呼吸机制调节氢离子浓度的效率为50~75%。假如PH突然从7.40降到7.0时,呼吸系统在一分钟内可使PH回升到7.2~7.3。
3、肾脏系统,因为肾脏能排泄不同程度的酸或碱,所以肾脏对调节pH也起着重要作用。肾脏调节血液PH的机制是一个复杂的反应过程,它取决于进入血液中氢离子的数量和在肾小管内发生的一系列反应。如氢离子的排出,钠离子的重吸收,碳酸氢盐离子以及氨的排出。进入肾小管的碳酸氢盐离子的多少,与细胞外液的碳酸氢盐离子浓度成比例,当细胞外液的碳酸氢盐离子浓度保持正常时,氢离子的分泌与碳酸氢盐离子的滤出保持平衡,彼此中和。正常代谢时,机体产生过量的酸,为了维持平衡,肾脏依靠以上机制排出较多的氢离子,所以 尿液常呈酸性。但是,若有较多的碳酸氢盐离子排出时,尿液呈碱性。肾脏对PH的调节作用同肺脏相比,其优点在于能全部中和进入体液中的过量的酸或硷,而呼吸系统仅有50~70%的效率;其不足之处是作用缓慢,在氢离子浓度发生突然变化时,需要几小时至五天或更多的时间才能得到调整。

判断酸碱失衡的基本方法
评价血液酸碱失衡的指标较多,其中PCO2作为判断呼吸性酸碱失衡的指标,PH作为血液酸碱度的指标,看法是一致的。然而,对于判定代谢性酸碱失衡的指标尚无统一意见。美国波士顿Schwartz派主张用HCO3-可信带作为判断标准,而丹麦哥根哈根Astrup派主张用BE作为判断标准。但不管哪种方法,其判断结果基本是一致的。本节主要介绍使用PH、PCO2、HCO3-、指标的判断方法。
(一)核实血气分析结果是否正确
当接到一帖血气报告单时,应如同其它检验结果一样,分析一下其准确性如何。以往常用西


常,则呼吸加深。肺泡气PCO2因而下降,动脉血PCO3亦下降。呼吸加深比呼吸加快对肺泡气的PCO2下降所起的作用更为重要。此时,肾脏也发挥代偿作用,主要依靠排除[H+]和回收[HCO3-]的作用。由此可见,肺脏的调节是使CO2的排出增加或减少,以代偿代激比酸中毒或碱中毒。肾脏的调节功能是使肾小管产生[H+]与回收[HCO3-]期增加或减少,以代偿呼酸与呼碱。据此说明,动脉血PCO2↑或↓和[HCO3-]的↑或 ↓,既可能是原发过程,也可能是继发性的代偿过程。所谓代偿就是以自身制造的酸中毒或碱中毒来攻击外来的因素所引起的碱中毒或酸中毒。国内有人将此代偿机制称为“以毒攻毒”,通过这种代偿机制维持PH值正常。但是,原发的内毒造成的“毒”,是真正的毒,对机体有害。代偿过程造成的“毒”是继发的,对机体有利。因此,我们的治疗目的应放到原发性“中毒”方面,积极保护继发性代偿过程产生的“毒”,这是处理酸碱失衡的一条基本原则。假如违背这个原则,不论代偿性还是原发性一概加以“纠正”,对机体是有害的。
(三)单纯性与混合性酸碱失衡的判断
单纯性酸碱失衡的血气判断比较容易,一般可根据PaCO2与[HCO3-]的变化进行推断。单纯 PaCO2,提示呼吸性酸中毒;[HCO3-] 或BES为正值,提示代谢性酸中毒。然而,PH变化只能说明有酸血症或碱血症存在,而不能说明由何种原因所造成的。
混合性酸碱失衡可分为相互加重型和相互相抵消型。相互加重型的特点是PH升高或降低明显。如重烧伤并发呼吸衰竭病人,患者可能既有呼吸性酸血症(PH↓),又有代激注酸血症(PH↓),结果导致PH严重下降。假如病人有哮喘症状,因过度换气而出现呼吸性碱血症(PH↑),若此时又补充碱性液体会使PH再度上升。相互抵消型酸碱失衡的PH变化不明显,如肾功衰竭病人血液PH下降,由于继发性呕吐而失去大量CI-,从而出现低氯碱血症,结果使PH变化不明显。

例:PaCO2=20mmHg,PH7.56,分析属何种酸碱紊乱。
急性烧伤病人不易出现,除非病人伤前有慢性呼吸功能障碍病史。如遇到此类病人,在公式应用方面请用公式②,即把PH预计值改为0.003。
如病人PH=7.28,PaCo2=80mMHg,属急性还是慢性呼吸障碍。
先将数值代入公式①,得PH为7.08与实测值相差太大;再代入公式②,得PH为7.28,与实测值一致,故应诊断为慢性呼吸性酸血症。
事实上,如此程度的高碳酸血症必然同时伴有代谢性紊乱,如果测得PH位于按急性与慢性计算公式所得数值以外,可以推断必然同时伴有代谢性因素参与。现举该类酸碱平衡失调的病例加以说明。
病人PaCO2=60mmHg,pH=7.18,分析酸碱失衡类型。
设原正常PaCO2为40mmHg,则PaCO2的变动值为(60—40)=20,若属急性酸碱紊乱,预计pH将改变(20X0.008)=0.16,pH应为:(7.40-0.16)=7.24;若为慢性酸碱紊乱, PaCO2增加20mmHg时,动脉血中H应降低0.06,PH应为(7.40—0.06)=7.34。因为实测PH为7.18,位于上述两种公式计算值之外。因此,可以推断呼酸同时并代酸。
再如病人PaCO2为60mmHg,PH为7.50,分析酸碱失衡类型。 设正常PaCO2为40mmHg,则PaCO2变动值为(60—40)=20,若属急性紊乱,预计PH改变为:(20 X0.008)=0.16,结果为(7.40-0.16)=71.24;若为慢性紊乱,PaCO2上升20mmHg时动脉血PH将降低外06,所得pH为:(7.40—0.06)=7.34。因为测得PH与上述两种公式计算结果均不符,故推断呼酸并代碱。
2.阴阳离子平衡公式的应用:根据阴阳离子平衡的机理。则:Na++ K++ Ca2++Mg2+=CI-1+HCO3-+蛋白质十SO42-十乳酸十HPO42-十酮酸
现以M代表K++Ca2++Mg2+(8mmol/L),R代表蛋白质十 SO42-+ HPO42-十乳酸卡酮酸 (25mmol/L)。
将M与R代入公式:
因为Na++M=Cl-+ HCO3-+ R,或Na+十8(mmol/L)=Cl+ HCO3-十用(mmol/L),故R一M=Na+一(Cl-+HCO3-)=17(均值17士2mmol/ L)。当血液浓缩造成血浆蛋白质增加,或是因尿毒症,乳酸血症酮症等造成R·A(固定酸)增大时,均能造成R.A增大,会超过20mmol/L。若在临床上能排除血液浓缩系因脱水造成的,则R—M增大 (表示R·A增大),亦说明为代谢性酸血症。如果R-M数值明显增大,结合临床可做出代谢性酸血症的明确诊断。因此,R-M是推算R· A是否增大的一个简易方法。
除了通过R-M计算R·A方法之外,还可根据R·A计算公式直接求得,即:R·A—Na++K++Ca2++Mg2++一(HCO3-十Cl十蛋白质)
正常值为9mmol/L。因为Ca2+和Mg2+通常不必测定,分可以2.5和1.5mmol/L代入公式。蛋白质的mmol/L数值等于血浆总蛋白(克)% X 2.43。
若R· A> 9mmol/L时,则表示代谢性酸中毒。
R·M公式不仅能计算R·A数值大小,也可验证实验室检查结果是否有误。在任何情况下R一 M值都不应小于5mmol/L,血清Na+不应等于血清CL-,更不能小于CL-。若出现上述情况,则表示检查结果有误。现举两例对此公式进行应用分析。
病人心跳骤停复苏后测定血清K+6mmol/L,Na +140mmol/L,Cl-96mmol/L,CO2-CP15mmol/L,则R—M=Na+-CI-+HCO3-)=140-(96十15)-29(mmol/L)。该病人R—M值比正常值(17±2mmol/L)增大,故提示R·A增大。结合病史可 诊断代谢胜酸血症(系乳酸增加所致)。
再如,一位急性全身性感染病人,体质消瘦,食欲下降,为负氮平衡状态。查血清钾4.ommol/t,Na+144mmol/L,Cl-102mmol/L,CO2-CP18m/L。则R—M=144(102—18)=24 (mmol/L)。该数值大于正常值(17±2mmol/L),提示R·A增大,结合病人有负氮平衡现状,可诊断酮症酸血症。
上述两例若用R·A直接计算公式,同样也能得出与R—M公式基本相近的结果。
3、缓冲碱计算公式的应用
缓冲碱(BB)的正常值范围为40~48mmol/L。
公式( 1): BB= Na+ + K+一 Cl--(正常值46mmol/L)
数值增大表示碱血症
数值下降表示酸血症
公式(2):BB=Na+一Cl-(正常值42mmol/L)
公式(3): BB= HCO3-十血浆蛋质十 HPO42-(血浆蛋白mmol/L=克%X 2.43;HPO42-通常以lmmol/L计算)。
公式(4):BB=41.7+HbX4.2+BE。
公式(2),(3),(4)判断方法与公式(1)相同。
4、“阳离子隙”公式的应用
根据细胞外液阳离子总和与阴离子总和相等这一“离子解剖”关系,血清中的Na+及K+代表细胞外液中的阳离子数,实际上上述阳离子是全部阳离子的95%(145/155);氯化物及HCO。等代表细胞外液中阴离子的85%(130/155)。因此,所测得的阴离子之和并不完全与阳离子之和相等,其差值由蛋白质,小量PO42-、SO42-及其它阴离子所填充,故得名“阴离子隙”,简称AG。
公式(1):AG=(Na++K+)一(Cl-十HCO3-)
因为血清钾浓度变化范围较小,对AG数值影响不大,故公式(1)可用公式(2)代替。
公式(2):AG=Na+一(Cl-+HCO3-)
根据国外许多资料报道,AG正常值大致为:12.4±2mmol/L,11±2.5mmol/L,Emmett认为AG正常值为12mmol/L。若病人 AG大于12~16m。l/L,往往提示有代谢性酸血 症存在,尤其在乳酸血症时,AG可高达20~30mmol/L。AG增高也见于脱水尿毒症,或某些抗生素应用后(如大剂量接千青霉素,或青霉素钠盐)。后一种情况不表示有酸血症。因其主要原因是钠负荷增加。呼吸性酸血症及代谢胜碱血症AG可轻度升高,但增加数值常小于2~3mmol/L。 AG下降常无临床意义,可见于低蛋白血症,血液稀释,高钠血症等情况。