- 急性呼吸窘迫综合征

-
目录
- 英文摘要
- 烧伤病人的多死因统计与死亡链分析
- 烧伤病人自身抗体检测及其临床意义
- 电损伤的治疗进展
- 急性呼吸窘迫综合征
- 湿润烧伤膏治疗成批大面积烧伤的护理
- 烧伤湿润暴露疗法治疗大面积烧伤病人的护理
- 大面积烧伤湿润暴露疗法休克期护理
- 湿润烧伤膏治疗26例溃疡临床报告
- 湿润烧伤膏在肛周脓肿切开术后的应用
- 湿润烧伤膏治愈慢性窦道2例报告
- 湿润暴露疗法治疗眼烧伤78例临床分析
- 湿润烧伤膏治疗骨裸露创面的疗效观察(附8例报告)
- 湿润烧伤膏治疗深部疮疡一例观察报告
- 一例特重烧伤晚期应用湿润烧伤膏治疗的体会
- 应用湿润烧伤膏治疗一例特大面积烧伤的救治体会
- 湿润暴露疗法治疗小儿烧伤72例报告
- 应用湿润暴露疗法治疗中小面积烧伤125例的体会
- 湿润烧伤膏在门诊应用(附82例报告)
- “MEBO”用于烧伤创面的疗效观察
- 湿润暴露疗法治疗烧伤191例临床报告
- 湿润暴露疗法治疗烧伤的体会
- “MEBO”在灭火现场烧伤患者中的应用
- 基层医院成批大面积烧伤的抢救体会(附“5.19”烧伤病人抢救经过)
- 湿润暴露疗法治疗烧伤面积98%的临床体会
- 首届颁发中国烧伤创疡科技进步奖
- 中国政府赴泰国烧伤医疗队救治烧伤取得成功
ACUTE RESPIRATORY DISTRESS SYNDROME
张林祥
急性呼吸窘迫综合征( Acute Repiratory Distress Syndrome)略语为ARDS,系自1950 年Tenkin首先提出的休克肺发展而来,后发现多种原因均可导致本征的发生,在1967年由AShbaugh提出呼吸窘迫综合征这一名称,国内多赞成这一名词术语。为区别婴儿缺乏肺表面活性物质导致的透明膜形成的呼吸困难,称为成人呼吸窘迫综合征( Adult Respiratory Dktress Syndrome),但不如急性呼吸窘迫综合征较为确切。这易区别于慢性阻塞性肺部疾病Cold(Chronl obstructlve lung diseas)。由于认识不断的提高,发现ARDS发生率较高,死亡率占休克的85%。总死亡率亦较高,1977年Lewis报告死亡率为35~40%。作者1982年总结死亡率为25%。
一、诊断标准和病情分期
Moore曾把ARDS临床过程分为四期,他所提供的概念有助于我们对综合征的认识和判断。
第一期:病人在受伤后数小时就呈现硷中毒,此与病人的持续过度通气,以及接受大量的碳酸氢钠和输血后木句椽酸被氧化,无不有关,由于组织血液灌流减少,病人可以有轻度乳酸血症。
第二期:血压、肾功能、高心血排出量等经治疗似有好转,但呼吸困难更趋明显,因持续过度通气和低碳酸血症,肺泡通气与血液灌流比例失调,增加了动静脉的生理分流,有时竟达到心排出量的18~20%或更高,使周身动脉血的掺杂增多,动脉血压分压(PaO2)降低,此间病人得到适当处理,仍可获得恢复。
第三期:除呼吸困难症状加剧外,由于肺内分流增加,此期病人死亡率很高。
第四期:缺氧症状更为显著和恶化,尽管潮气量可高于正常,仍不能纠正低氧血症,血内硷贮备减少(代谢性酸中毒),二氧化碳分压增高(呼吸性酸中毒),PH下降,心动过缓、心电图QRS波丛增宽,最后心搏停止,虽经积极心脏复苏,亦难恢复。
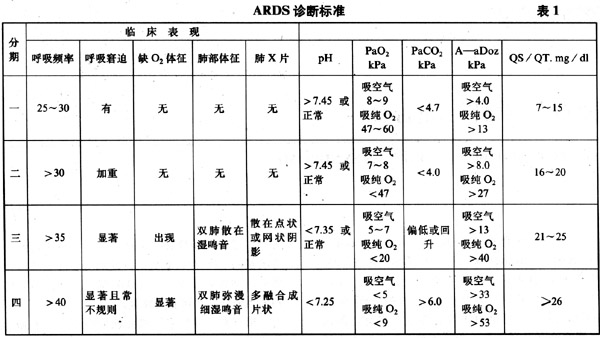
根据天津市第一中心医院急性三衰抢救研究室就1979年三衰会议分期进行修改后的临床分期较为适用,特介绍如表1所示。
二、病因及发病机理
肺在机体内有着特殊的生理学性质,它是唯一接受全部心输出量的器官,而且与大气又有大面积直接接触,因此,极易受到血流和大气原因所造成的损害,而肺又对这个损害反应能力有限,尽管引起ARDS的疾病很多,原因各有不同,但对肺损害的表现十分相似,因肺泡——毛细血管膜损害增加内皮和上皮的通透性,从而增加血管内液逸入间质和肺泡腔,终致肺水肿。同时又因肺表面活性物质生成代谢障碍,促进肺功能进一步下降。
大致可以从九个方面来了解引起ARDS肺损伤的病因及其机理。
(一)直接引起肺损害的因素
1.氧毒性:高浓度氧直接造成肺和其它器官系统的功能障碍和细胞损害,尤以肺为氧毒的靶器官,在海平面吸入氧分量(FiO2)可作为氧毒性水平的指标。但在高气压下就是降低FiO2也可出现毒性作用。由此可见与毒性直接相关的是吸入气氧张力(PiO2),而不是FiO2 FOX等报告:氧化多引起肺损害的机理是因损害了肺泡巨噬细胞,后者释放出多种化学趋向素 (Chemotaxine)而把中性白细胞诱聚于肺AtmO2示为“毒性有效剂量”。一般在吸1个At O260小时之后呼吸困难症状始呈明显。
2.胃内容物误吸引起ARDS的发生:胃内容物的pH多低于2.5,在误吸后数秒钟之内,胃内容即可散布到广泛肺野,即可出现损害,数小时内I型肺细胞坏死,从基底膜脱离并为多形核细胞所浸润,毛细血管内膜损害和含有丰富蛋白质的液体逸入间质和肺泡内,结果出现肺水肿和肺顺应性下降,由于肺表面活性物质的消失,促使出现广泛的肺不张。
3.其它:如急性放射性损伤,多发生在治疗开始l~3个月,直接损害肺泡上皮和血管内膜,造成肺间质水肿;毒气吸入可直接引起肺泡—毛细血管内皮的损伤。
(二)通过体液因子引起的损害
许多血管活性物质可引起肺泡—毛细血管通透性增加,继而出现液体在肺间质及肺泡内堆积,这些物质包括组织胺、5一羟色胺、徐缓激肽、前列腺素、血栓素、内毒素、纤维蛋白降解产物等。
(三)网状皮内系统抑制和 Fibronectine缺乏:
RES特别是肝脏在清除血小板一维蛋白凝集或其它形成微栓子作用,对发生ARDS具有重要作用,创伤和脓毒血症病人的RES功能均明显受抑制,如果不能清除微粒,势必要增加肺内的微粒栓塞,肺内枯否细胞是清除血内微粒的重要场所,但微粒的清除受调理蛋白(Oposonic protein)所制约,它是一种糖蛋白称之为Flbronectine,血浆内Fibronectine对胶原和纤维蛋白复合物有高度亲和力,为吞噬作用所必要的条件。但在任何大创伤后Fibronectine受抑制,对ARDS的发生而起一定作用。
(四)血液细胞成分引起的肺损害:
多形核中性白细胞(PMN)是肺和其它器官炎症过程中一个重要的参与者,它是通过释放溶酶体蛋白酶经不同途径而造成细胞损害;组织蛋肽原的作用而形成的细胞激肽,后者是一种强的血管活性胺,其作用与徐缓激肽相似,比后者强数倍。
血小板:当血小板显露于胶原、ATP、凝血酶时,则呈集聚现象。血小板可释放头羟色胺、 前列腺素、溶酶体蛋白酶、肝素释放因子和增加膜通透性因子等。其引起肺损害的原因可能为(l)因血小板集聚而阻断肺毛细血管;(1)释放弹性硬蛋白酶和胶原酶而造成组织的破坏;(3)通过前列腺素、5一羟色胶和其它血小板因子引起膜通透性和毛细血管静水压增加;(4)通过血小板酶而激化补作,间接使白血球诱发损害。
(五)肺道流不足:
一般认为在低心血输出量情况下,就可引起肺泡—毛细血管膜的损害,正如Stand指出的:低氧症不能引起肺泡—毛细血管膜完整性的损害。就是在无氧代谢的条件下,膜功能仍可维持,但临床上所见的休克,却不单纯是低灌流问题,而常伴有软组织损伤、脓毒血症、酸中毒、大量输血等,尽管低灌流并非导致肺损害的主因,但在一定条件下,它对肺的损害起着推波助澜的作用。
(六)肺损害并发干凝血的异常
严重创伤引起组织凝血酶的释放,在血内将出现纤维蛋白和凝血酶的形成。凝血酶、纤维蛋 白和血小板形成的微检堆积在肺内,它不仅造成 机械性梗阻,而且从血小板和凝血阶式系列 (Coagulation Cascade)变化所释放的体液因子,引起肺血管收缩,肺高压和一定程度膜通透性改变。在正常情况下,纤维蛋白可以迅速溶解,微栓的异常生理现象只是一时性的,但在创伤后地茶酚胺释放而刺激脂肪分解,使游离脂肪增加,从而增加肝脏合成纤维蛋白溶解原抑制体,以致纤维蛋白溶解障碍,微栓持续滞留在肺循环内,促使毛细血管通透性增加和肺水肿的出现。
(七)脂肪栓塞与脂酸
大骨折后所出现的脂肪栓塞综合征不仅累及中枢神经系统,且导致呼吸功能不全,造成肺栓塞的脂滴,经肺糖蛋白脂酶而断裂为游离脂酸,有害于毛细血管膜,其结果引起肺水肿,肺表面活性物质失活和肺不张。
(八)神经原性
中枢神经受损后,可暴发呼吸功能衰竭。表明神经原因素可迅速导致肺损害,其机理为通透性增加,还是肺高压所致曾有争议。据最近资料表明,两者均为发病因素,而肺高压更重要。
(九)其它
肺内皮细胞所具代谢功能与呼吸功能一样,对一些生物胺、肽、前列腺素的代谢很活跃,为降解血清素、去甲肾上腺素重要场所。ARDS病人出现低血压可能与降低血内这些活性物质水平密切相关。
三、病理解剖
在临床症状出现后头18小时,肺大体表现不甚显著,仅有少量散在的充血和肺不张区,在休克后18~72小时,则病变较为严重,整个肺叶呈出血性突变,镜检有严重肺静脉充血,散在的血栓栓塞形成,间质水肿,血管和支气管周围出血和肺泡出血,72小时之后可见透明膜和支气管肺炎,继而出现弥散性纤维变性的改变,渗出性增殖性改变可同时相间存在。改变的特点可归纳如下:
渗出期(2~96小时)
肺泡和问质水肿,毛细血管充血,I型肺泡细胞破坏,早期透明膜形成。
细胞增殖期(3~10天)
增殖II型细胞,肺泡隔的细胞浸润,透明膜的机化。
纤维增殖期(>7~10天)
透明膜和肺泡隔的纤维化,典型病变,肺泡管纤维化。
四、ARDS的预防与处理
一旦出现ARDS预后较为严重,处理也复杂和困难,重要在于预防及早期治疗。对休克、重度创伤病人,尤应注意以下数点:1.发生休克后迅速恢复循环血容量;2.保留气道内导管,直至病人完全清醒及充分的通气;3.积极鼓励病人进行深呼吸;4.经常更换体位;5.凡输血超过4个单元者,应使用标准的滤过器过滤,应尽量避免过多地输注陈旧的库存血液,作者组两例病人作肝脏手术,术中输入大量库存旧血,创面出血不止,同时并发DIC及ARDS,经用新鲜血及纤维蛋白元后出血基本停止,但ARDS不能控制,先后于术后第2日及第6日死亡;6.补充高营 养;7.控制过量过快输液;8.给纯氧不宜时间过长,最好应用40%浓度的氧气;9.防止胃液误吸入肺:神智昏迷病人易于发生胃液人吸入肺,胃液能破坏肺泡组织而发生ARDS,又是肺部感染的原因,在病因章节中已加介绍,故对昏迷病人应提高警惕。
治疗ARDS的两个重要环节是:1.通过辅助给氧,维持组织充分氧合,支持受损肺的恢复;2.积极防止危及生命的并发症的发生:使肺泡满意的扩张,以增加功能残气量(FRC),改善与保护组织的灌流;控制原发病因。
(一)给氧及机械性通气
对ARDS的治疗,在早期可经导管、鼻塞或面罩吸氧,可提高吸入氧浓度(FIO),提高PaO2,增加对组织的氧供,以补偿氧耗的增加,延缓病情的发展,提高FiO2虽不能使Hb结合氧明显增加,但可由于PaO2的增高,血浆溶解民 增加幅度较大,此部分OZ不受其它因素影响,可根据氧分压差,直接释放到组织如PaO2由13.3KPa(100mmHg)增至80KPa(600mmHg),则血浆溶解氧则由0.3ml/dl,增至l.8ml/dl,达到正常释氧量(约5ml)的1/3 以上,可在一定程度上补偿民耗增加i心输出量(CO)及微循环供血的减少。
经一般氧疗法缺局仍不能改善,甚至继续加重时,应争取作机械通气。
1.机械通气指征:
天津第一中心医院三衰室提出机械通气指征为:(1)FiO2超过40~50%而PaO2<8士0.7KPa (60士5mmHg);(2)A—aDO2值FiO2为0.21时本值>4KPa(30mmH动或 FiO2为1时本值> 13KPa(100mmHg);(3)PaCO2> 6KPa(45mmHg),提示存在通气不足;(4)呼吸频率>30次/分或小于5次/分;(5)潮气量<5ml/KG;(6)PvO2<4.7KPB(35mmHg);(7)对慢性呼吸衰竭患者吸氧浓度 >30%而PaO2仍低于6.7KPa(50mmHg)或PacO2> llkPa(80mmHg),经用呼吸兴奋剂无改善者。上述指征很有参考价值。
2.辅助呼吸与外控呼吸的选择:
首先考虑辅助呼吸,当出现下列情况时,宜改用外控呼吸(有自主呼吸者应先用神经肌肉阻 滞剂如吗啡、箭毒等阻断患者的自主呼吸)。(l)严重呼硷;(2)严重呼酸;(3)患者胡主呼吸与呼吸器不同步。
3.加压通气治疗:自发呼吸存在时,可行间歇正压辅助呼吸(IPPB),即在吸气相施加正压 以增加潮气量,自发呼吸微弱或停止者,可行间歇正压通气(IPPV),即完全以机械通气代替病人的自发呼吸。经过施行IPPB或IPPV提高FiO2和改善微循环措施,仍不能使低氧血症好转时,则应使用呼气终末正压机械通气(PEEP),大量临床实践证明PEEP是治疗ARDS的最有 效方法。
IPPV时呼气终末气道压力为零,PEEP则不降至零,而保持一定正压IPPB+PEEP称为持续气道正压呼吸(CPAP),IPPV+PEEP称为持续气道正压通气(CPPV),应用CPAP如能纠正低O2血症,则不必再用其它通气方式。
(l)PEEP治疗的主要机理:
a.由于气道在整个呼吸周期始终保持正压水平,由于通气末正压的支撑作用,防止终末小气 道的过早关闭和肺泡的完全回缩,可使原已闭锁 及萎陷的小气道和肺泡复张,增加了肺泡功能单位。
b.肺泡内气体压力升高,可阻抑肺泡及肺间质水肿液的形成和集聚,而增加了肺内滞留气量,使功能残气量显著增加,肺顺应性改善,死腔减少,通气增加,分流减少,肺泡内PO2升高弥散加快,PaO2上升,升高的PacO2下降,A一aDO2递差变小。
c.有助于保存肺泡表面活性物质,从而缓解了因表面张力增加引起的肺泡萎陷。
d.此外机械通气还可减少呼吸肌的氧耗。实验证明:CO降至正常的30一40%时,隔肌活动增加(2)PEEP付作用及对策:可影响回心血量,对已存在血容量不足的病人更易弓随血压下降;压力过高可对肺形成氧压伤,造成气胸或纵膈气胸的危险,以及发生透明膜病等。在开始应 用时最易发生并发症,初选潮气量可为10~15cc/公斤,若仍处于低氧血症,要应用毒性浓 度的氧时,则用FiO2>0.5,PEEP从3-5cm、 H2O开始,随后再增加3~5cmH2O,直至获得满意的氧合。一般病人只要血容量充足,5~10cmH2O的PEEP皆能较好地耐受,但不宜超过 15cmH2O以上,对慢性梗阻性肺病不宜应用。应用过程应避呼硷随时检查MPAP、PAWP,如条件受限可观察CVP;进行血气分析,来调整PEEP压力;控制吸氧浓度以FiO20.4~0.5为合适,如PaO28KPa以下,可暂时提高到1.0,待PaO2改善,迅速改为0.4~0.5,维持8~10KPa。
(2)高频通气HFJV
国内外近年来推广使用HFJV用于治疗ARDS取得良好效果,此法优点增加呼吸频率(>60次/分)而减少气道压力及潮气量,对心血管无不利影响,而达到使肺的氧合改善,用KR- II型喷射型呼吸机,给与高频通气,以潮气量100~150cc,每分钟60~200次,个别增至200~300次/分,氧驱动压0.7~1.5KG/cm2,这种KR-II型喷射式通气,只要保持呼吸道通畅和气道湿化,效果较好。以潮气量150cc,每分钟60~200次,吸氧相占30%,可使肺内气体均匀,有效地进行通气和换气,由于潮气量小,具有低气道压、低胸内压,肺胸廓顺应性减低又不损害气管粘膜,心脏循环负担轻,而仍能取得足够的肺泡通气量和血液氧合效率的优点,且呼吸机结构简单、轻便、性能稳定、容易掌握,值得推广,特别适用于不适应PEEP患者,目前有普及取代PEEP趋势,如果趋动压偏高,而湿化又不好,也有损害气管粘膜的危险,故湿化气道非常重要。
目前有些作者认为某些疾病过程早期,可能缺乏或只有少许胸部X线改变,可试用PEEP预防治疗,以改善肺功能,预防ARDS的发生。有人将112例可能发生ARDS病人分为两组,一组用PEEP预防,一组作对照,结果PEEP56例中只有一例发生ARDS,而对照组有10例发生了 ARDS,也有人认为预防治疗无价值。
体外膜式氧合器ECMO用来治疗重症肺炎、肺挫伤、ARDS重症。凡经PEEP100O氧气吸入,PaO2仍在6KPa以下的患者,而渡过危险期有可能有者可用。目前由于性能尚不十分理想,操作复杂和存在一定并发症,以及代价高昂,还不能广泛应用。
(二)肺移植
目前对排异反应引起的肺水肿、肺纤维化、融合性肺炎尚缺乏有效措施,Veith报告25例肺移植,生存期最长10个月,最近又有新的进展。
(三)人工肺移植
生物人工肺尚在动物实验阶段。
(四)低体温疗法
当吸氧浓度达60%,而PaO2仍低于8KPa(60mmHg),可降低体温31℃左右,以减轻氧耗及CO2的产生,从而能降低吸氧浓度,以减轻肺损伤。
(五)控制液体摄入及利尿剂的应用
对创伤、休克病人要及时补液,但应及时观察有关项目,如输入晶体,其中80-90%容易迅速离开血管;重症病人处于分解代谢状态,每日约失去300~500克体重,若体重不减反而增加,则表明体液滞留,特别是PAWP增高时,除应控制液体输入外,还应使用利尿剂,可间接地减低肺间质水份。Tuleon氏报告在无感染者大量输液ARDS发生仅为5%,而有感染者高达77%,故对已有感染者输液时,更应注意过量问题。
(六)白蛋白的应用
意见尚不一致,如Giordana的实验,输入白蛋白可使肺血管阻力迅速恢复正常,而认为早期输入白蛋白对预防肺水肿有益,而Cucas观察中发现创伤病人输入白蛋白可使肺动脉压、楔压和中心静脉压升高,持续5日之久,且肺分流量也增加29%(对照组为19%),认为用白蛋白是不利的。也有人认为给浓缩白蛋白30~60分钟再给足量利尿剂效果满意。作者有两例ARpS病人输入白蛋白后进行利尿,ARDS有所减轻。
(七)肾上腺皮质激素:
应用药理学剂量,早期(24-48小时)短期应用,可能是有血无害的。主要效果在于刺激II型细胞产生表面活性物质,稳定肺泡功能,防止肺泡萎缩,改善生理分流,纠正低氧血症,还可减轻肺泡水肿,增加心脏收缩力,稳定溶酶体膜,并有阻断以受体的作用,减轻血管收缩,从而改善微循环。我们曾有一例脂肪栓塞满意。
(八)对ARDS的其它药物治疗
1.肝素:有人主张应用肝素治疗ARDS,理由为:ARDS肺部证实有纤维蛋白沉着,其降解产物,可能引起肺损害,但目前尚无定论。有合并DIC者当然根据情况应用肝素,但应注意过量问题。
2.柳肽酶:用于预防治疗各种纤维蛋白溶解引起的急性出血,由于严重休克状态,因其能抑制血管舒张素,从而抑制其舒张血管、增加毛细血管通透性、降低血压作用。
3.消心痛、酚托拉明等解痉物质,以解除肺血管痉挛。
4.洋地黄类药物,用于合并心衰或因正压通气引起的心功不全。
5.呼吸兴奋剂:在严重缺氧及CO2潴积时,应给予呼吸兴奋剂,如盐酸DoxaProm能提高潮气量,增加呼吸频率,刺激末梢化学感受器;防止氧吸入引起的呼吸抑制。
6.抗菌素:除用于全身感染外,即使无感染,在发生ARDS后的肺感染,也有预防及治疗作用。
(九)英薯类药物的应用
莨菪类药物治疗休克的基础是阻断 及M受体,解除微循环障碍,改善灌与流的问题,同样也解除肺的微循环障碍,减除肺间质水肿,促使肺泡积液的再吸收,使肺泡功能再恢复。肺本 身除具有一般组织或器官的微循环外,还具有本身特点:即低压、低阻、高流量。休克时肺毛细血管前后括约肌较体循环为大,可达正常的五倍,肺静脉有丰富的神经支配,当动脉丧失收缩能力而扩张时,而肺静脉处于收缩状态形成“血池”,体液继续外渗至间质及肺泡。此即是周身微循环改善后,仍发生或不能纠正呼吸窘迫综合征的原因。东莨若硷是强而有力的 及M受体阻滞剂,对休克发生的微循环障碍有特别的效应,对肺微循环改善也是强而有力。此外还有兴奋呼吸作用,使呼吸幅度增大改善了肺的吸氧能力,且明显改善了毛细支气管痉挛而增加了通气效应,减少了分泌量,使分泌明显减少或消失。在临床应用过程中,应用东英若硷后肺吸音明显减少或消失。X线除肺部已有感染尚在短期残存炎症痕迹外,均在病情稳定后消失。本品具有镇静大脑皮层作用,减少病人的烦燥不安,从而降低了氧耗。与酚托拉明具有同样“内放血”作用,而无血压下降的危险,改善了微循环,增加了有效循环量。并具有保护脑细胞作用。作者两例乙脑病人发生严重休克共发ARDS先后昏迷14及18天,由于应用了东莨若硷,醒后未留下明显脑后遗症,神智基本恢复正常。应用东巨著硷气管分泌物减少是疗效的反应,不是造成不易吸痰的原因,如能很好地湿化不会形成痰栓。东英若硷 的用量应根据不同病情而异,有休克状态时,用量应偏大,而在应用呼吸机时用量可稍小,在脱机前后及呼吸功能明显好时,可每6小时0.3mg,不应过早停药。
作者单位:本刊编辑部