- 皮肤软组织扩张自由基水平的初步研究

-
目录
- 英文文摘
- 论文文摘
- 烧伤监护与临床处理 第十讲 抗菌药物与抗炎物质
- 眼睑及睑缘色素痣的美容外科治疗
- MEBT治疗大面积烧伤84例护理体会
- MEBO在皮肤磨削后的应用(附36例报告)
- MEBO联合CO2激光治疗腋臭50例临床观察
- 尖锐湿疣CO2激光术后应用MEBO的探讨
- 用MEBO治疗青年挫疮25例报告
- MEBO治疗带状疱疹48例观察
- MEBO治疗急性外阴溃疡33例报告
- 湿润暴露疗法治疗擦伤54例体会
- 烧伤老人败血症18例临床分析
- 小儿特重烧伤并发消化道出血
- 干湿疗法各治愈一例特大面积烫伤比较
- 应用干湿疗法治疗小儿烧伤50例临床对比分析
- MEBO治疗食管腐蚀伤的长期疗效观察
- MEBO对4373例烧伤创面止痛疗效分析
- MEBO治疗电烧伤48例报告
- 硫酸灼伤的伤因调查与MEBO疗效分析
- MEBO治疗小儿烧伤94例临床分析
- 成功救治一批烧伤病人的临床体会
- 基层医院应用MEBT救治大面积烧伤体会
- 皮肤软组织扩张自由基水平的初步研究
- MEBO治疗家兔黄磷烧伤的初步探讨
- MEBO对家兔角膜上皮缺损愈合速率的对比性研究
- 兔烫伤MEBT与干性暴露疗法抗休克效应对比实验
- MEBO抗感染机理的动力学研究
- 皮肤微循环血管树的实验形态学研究(十)
- 从方法论上看湿性与干性疗法的不同治疗观
A PRELIMINARY STUDY OF THE LEVELS OF FREE RADICALS IN SKIN OFF FREE RADICALS IN SKIN SOFT TISSUE EXPANSION
广东医学院整形外科研究所 李建兵 郝新光 梁杰 颜大胜
〖内容摘要〗实验动物S-D大白鼠背部置入20ml扩张器,常规扩张23-25天,于最后一次扩张(达20ML)前、扩张后1H、6H、12H和24H分别测定扩张皮肤组织中的SOD活性和MDA含量扩张后1H、6H及12H与扩张前比较差异有非常显著性(P<0.001;至扩张后24H基本回复到扩张前水平(P>0.05);SOD能增加扩张面积、长度,以16-24天最明显(P<0.05)。探讨自由基对组织扩张的影响,为安全、快速及有效地进行皮肤组织扩张提供新的思路。
关键词:皮肤 组织扩张 自由基
皮肤软组织扩张术近十余年来以其独特的优点――提供与受区毛发、色泽、质地及感觉相匹配的"额外"皮肤软组织在整形外科领域得到广泛的应用。但其并发症较高、疗程较长度使其应用受到限制。许多研究表明,自由基在组织缺血/再灌流损伤及硅胶纤维囊形成中起重要作用。本研究观察组织扩张氧自由基的形成及自由基清除剂SOD对扩张面积、长度的影响,为安全、快速及效地进行皮肤软组织扩张提供新的思路。
一、 材料与方法
(一) 实验材料:
1. 动物:S-D大白鼠,雄性,健康,无皮肤疾患,体重250-300G,共76只。
2. 主要仪器:72型可见光分光光度计,皮肤扩张器,20ML,圆形,ZS83-1型内切式组织匀浆器;多道生理记录仪。
3. 主要试剂:MDA、SOD试剂盒由南京建成生物工程研究所提供;牛血SOD由上海系列化所东风生物技术公司提供。
(二) 实验方法:
1. 实验分组:S-D大白鼠56只,按随机化原则将动物分为三组:(1)A组(剥离组):8只,将鼠背部皮肤掀起后原位缝合;(2)B组(不扩张组):8只,将扩张器置于皮下,注射壶亦置于皮下,同时注水4ML,以减少出血;(3)C组(扩张组):40只,鼠背部放置扩张器每隔3-4天注水2ML。
另取20只S-D大白鼠随机分为超氧化物歧化酶(SOD)治疗组和生理盐水(N.S)对照组,每组10只。
2.操作步骤:用2%戊巴比妥钠腹腔注射麻醉(40 MG/KG),8%硫化钠背部脱毛,在距尾部约5㎝处作一与脊柱垂直的正中切口长约2㎝,于皮肤肉膜下钝性分离,范围约3×3㎝,将扩张囊置于分离腔隙,注射壶经皮下隧道置于头侧皮下,SOD治疗组和N.S对照组于扩张皮肤顶部纺纹出1×10㎝正方形及与脊柱垂直的3㎝长直线。动物室温下单笼饲养,术后三天腹腔注射青霉素40万U,2次/日。
A组、B组不进行任何治疗,C组每隔3-4天注水2ml;SOD治疗组每次注水扩张后第一个24小时内腹腔注射SOD10000u/kg,q.6.h,N.S对照组腹腔注射等量0.9%N.S。SOD治疗组扩张囊内的注射水量以产生与N.S对照组相同囊内压为标准。
3.组织匀浆的制备:于扩张不同时间(每组6-8只)从扩张囊顶部切取全层皮肤组织用4C生理盐水冲洗表面的血液,拭干,用电子天平称取200MG组织,加4CN.S(0.9%)1:10(W/V),在冰水浴中用小剪尽快将组织剪碎,然后将盛有组织块的小瓶在冰水浴中用内切式组织匀浆器匀浆30秒,间隔60秒,共3次,制成的10%组织匀浆用低温离心机(4C)离心3000转/分×15分,吸取上清液,贮于低温冰箱,一次检测。
4.观察指标:
(1)按试剂盒说明书操作检测组织中SOD活性和MDA含量,同时用FOLIN酚法测定皮肤组织中蛋白含量,用比活性(U/MG蛋白)表示SOD活性,用比浓度(NMOL/MG蛋白)表示MDA含量。
(2)应用SOD后,测量每次扩张的面积、长度。
(三) 统计学处理:
SOD、MDA数据以均数(X)+标准差(S)表示,容量以实际容量占总的百分比表示,面积、长度以每次扩张增加的百分数表示,用成组比比较的T检验判断组间差异有晚显著性。
二、 结果
(一) 本实验扩张后期变化:
有3只动物因扩张皮肤坏死,扩张器外露而未列入实验对象。MDA和SOD测定结果见表1。
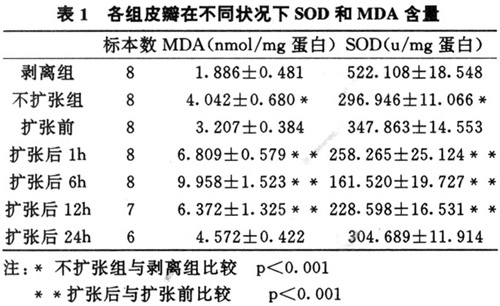
皮肤软组织扩张后早期,由于皮瓣急性缺血,ATP代谢水平下降,ATP转变为次黄嘌呤,产生氧自由基,使生物膜上的不饱和脂肪酸发生脂质过氧化,引起长链反应,使其终末代谢产物MDA含量增高,SOD活性下降。然后扩张皮肤逐渐变软,血运随之增加,缺血改善,SOD活性不但没有回升,反而进一步下降,MDA含量亦进一步升高,至扩张后24小时基本回复到扩张前水平。不扩张组与剥离组比较,差异有显著性,可能是由于硅胶刺激促使自由基形成。
(二)N.S对照组与囊内压变化(见表2):
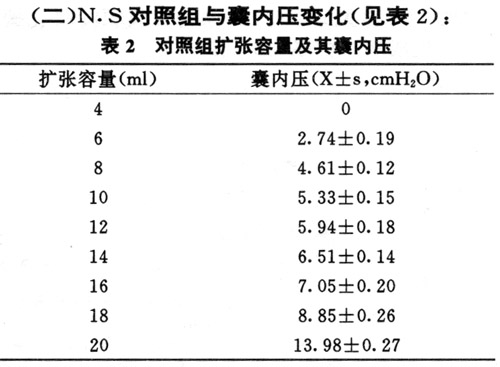
表2显示每次注水扩张后,扩张囊内的平均压力。体外实验表明,扩张囊内注水量不超过其容量时,囊内压力为零。扩张囊内压力主要来源于覆于其上的皮肤张力。该值作为治疗组注水量的标准可避免治疗组与对照组扩张的不一致或过量扩张导致皮肤组织的过度延伸或破裂,便于实验研究。
(三) 扩张过程中容量、面积及长度变化(见表3):

结果显示:应用SOD后增加扩张速率。特别是扩张的第16-24天之间,相同囊内压能使扩张面积、长度明显增高(P<0.05;治疗组与对照组的扩张容量变化表明治疗组能在较短时间使扩张容量达100%(20ML)。
三、 讨论
(一) 皮肤软组织扩张过程中自由基的产生机理:
皮肤软组织的每次扩张,由于扩张囊内压力作用于扩张组织,使之毛细血管闭塞,导致急性缺血,且由于扩张顶部侧部等部位所受压力不同,缺血程度不一,这种缺血状态(较扩张前)在早期尤为明显,然后由于皮肤软组织的粘弹性特性,组织间液的重新分布,胶原纤维的重新排列,表皮细胞的分裂增殖,使扩张皮肤变软,并且由于缺血、缺氧的刺激,毛细血管增生,开放,血运逐渐恢复。这种现象提示存在缺血/再灌流过程。缺血时组织血供减少或消失,细胞进行无氧化谢,ATP分解为腺苷酸,然后成为次黄嘌呤核苷、次黄嘌呤和黄嘌呤。黄嘌呤脱氢酶转变为黄嘌呤氧化酶,组织再灌流时,缺血时生成的次黄嘌呤、黄嘌呤在黄嘌呤氧化酶的参与下生成氧自由基,如下图。
组织缺血/再灌流时自由基产生机制示意图。
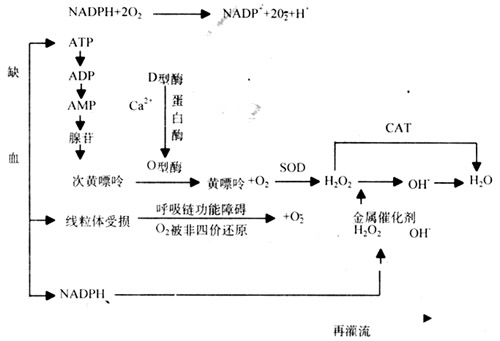
无论是动物还是人体,一定时期后硅胶囊周围逐渐形成纤维囊。并且其形成过程中有大量的氧自由基产生。至于其形成机理尚不完全清楚。许多学者认为,硅胶假体尽管化学性质极其稳定、组织相容性好,但仍硅胶微粒逸出进入假体周围组织,尤其是直径为10-60㎝的硅胶微粒,作为一种抗原或半抗原诱发免疫反应,趋化吸引白细胞,白细胞膜上的还原型辅酶II的电子传递给氧,产生氧自由基。NDAPH+2O2→NADP+2O2+H。氧自由基产生后可趋化吸引白细胞浸润,构成恶性循环。这是纤维囊内氧自由基的主要来源。本实验结果显示,放置扩张组与剥离组比较,MDA含量增高,SOD活性降低且差异有显著性,说明硅胶纤维囊形成过程中产生了氧自由基,与国内外文献报道相符。
(二)SOD的抗损伤作用:
SOD催化O2生成H2O2,后者可进一步生成H2O2,它是体内自由基清除系统的主要成分。SAGI证实,动、静脉阻塞11H SOD能改善皮瓣存活。MANSON对鼠腹部岛状皮瓣缺血12-24H游离移植,用单剂量SOD处理存活76%,而对照组织只有38%存活。说明SOD对挽救缺血皮瓣起重要作用。1990年ECKERT将SOD注入硅胶与其周围形成的纤维囊之间,结果纤维囊厚度减少50%;1992年陈小平应用SOD注入放置硅胶体形成的纤维囊内,得到相似的结果。皮肤软组织扩张导致皮瓣缺血及硅胶微粒的刺激,生成大量自由基。超过体内自由基清除能力,引发自由基连锁反应,以及生物膜上的不饱和脂肪酸发生脂质过氧化反应,诱导蛋白质、核酸氧化破坏和交联。特别是包括SOD在内的酶的破坏。并且自由基可在两个环节上促进胶原合成加速:
(1) 充当原胶蛋白粘化为胶原蛋白的中间体。
(2) 直接非酶性羟化原胶原蛋白使其转化为胶原蛋白。
在组织扩张过程中应用外源性SOD提高了扩张皮瓣中SOD活性,从而可以清除扩张过程中形成的氧自由基,抑制胶原合成,减少纤维囊的形成,进而提高扩张效率。本研究通过测定扩张容量、面积及长度变化,表明SOD能在一定程度上缩短扩张时间,提高扩张效率。为安全、快速及有效地进行组织扩张提供新的思路。至于自由基清除剂应用以后组织学改变、给药途径、剂量的选择及临床应用,有待进一步研究。
参考文献
〖1〗 Radovan C. Tissue expansion in soft-tissue reconstruction. Plast Reconstr Surg. 1984;74(4):482
〖2〗 Mccord JM. Oxygen-derived free radicals in postischemic tissue injury. N Engl J Med . 1985;312:159
〖3〗 Manders EK, Schenden MJ ,Furrey JA ,et al.Soft-tissue expansion: concepts and complication. Plast Reconstr Surg. 1984;74 (4):493
〖4〗 Angel MF, Ramasastry SS, Swarts WM, et al. Free radicals : bastic concepts concerning their chemistry, pathophysiology, and relevance to plastic surgery . Plast Reconstr Surg. 1987; 79 :990
〖5〗 Eckert P, et al. The influence of superoxide dismutase on constrictive capsular fibrosis. Eur J Plast Surg. 1990;13:16
〖6〗 陈小平等,硅胶纤维囊的自由基检测,中国修复重建外科杂志,1992;6:177
〖7〗 谭谦,马文熙,陈怀红等,超氧化物歧化酶对烧伤创面微循环影响的实验研究。中华整形烧伤杂志1995;11(1):77-79
〖8〗 Mustoe TA, Bartell TH, Garner WL. Phyasical, biomechanical , histologic, and biochemical effects of rapid verus conventional tissue expansion . Plast Reconstr Surg . 1989;83:687
〖9〗 Siegert E, Weerda H, Hoffmann S, et al. Clinical and Experimental Evaluation of Intermittent intraoperative Shot-term Expansion . P. R. S. 1993;92(2):248
〖10〗 Sagi A, Ferder M, David BS. et al. Improved survival of island flaps after prolonged ischemia by perfusion with superoxide dismutase. Plast Reconstr Surg. 1986;77(4):639-642
〖11〗 Manson PN, Narayanan KK, IM MJ, et al. Improved survival in free skin flap transfers in rats. Surgery 1986;99:211
〖12〗 陈小平,郭光昭,李松春等,氧自由基清除剂对硅胶假体纤维囊厚度的影响,实用美容整形外科杂志,1994;5(3):152
〖13〗 方允中,李方杰主编,自由基与酶,第一版,北京:科技出版社,1988;172
〖14〗 White MJ, et al. Oxygen free radicals and wound healing. Clin Plast Surg. 1990; 17(3):473