- MEBO作用机理实验研究之一

-
目录
- 英文文摘
- 湿润烧伤膏治疗冻疮36例临床分析
- MEBO对Mils'术术后伤口疗效观察
- MEBO治疗Ⅱ度急性放射性皮炎临床观察
- MEBO治疗体表溃疡86例体会
- MEBO在体表溃疡中的应用
- 应用MEBT治疗一例特大面积重度烧伤病人的护理体会
- 美比欧疤痕平治疗疤痕皮肤42例
- MEBT临床应用中有关烧伤病人美容问题的探讨
- MEBT救治162例重度烧伤休克期补液体会
- 烧伤合并呼吸衰竭的诊断与治疗
- MEBO治疗化疗药物所致皮肤坏死13例报告
- MEBT/MEBO治疗手部烧伤临床疗效观察
- MEBO临床治愈蒽、咔唑烧伤10例报告
- MEBO治疗黄磷烧伤的临床体会
- 48例电烧伤临床疗效分析
- 全程湿润暴露疗法治疗电流烧伤
- MEBT/MEBO在婴幼儿与学龄前儿童深度烧伤创面的应用与疗效评价
- MEBT治疗340例烧伤患者体会
- 湿润包扎疗法治疗烧伤1300例临床体会
- MEBT治疗1135例烧伤临床分析
- 应用MEBO治疗一批28例烧伤患者的体会
- MEBT与干燥疗法治疗烧伤325例临床疗效对比分析
- MEBT与烧伤干性疗法临床200例疗效分析
- 干转湿法治愈一例特大面积烧伤的体会
- 论MEBO治疗各类创疡病4954例的综述报告
- 烧伤脂蛋白复合物的临床效应
- 湿法治疗化学性烧伤需要探讨的几个问题
- MEBO作用机理实验研究之一
- 浅谈烧伤湿性医疗学术的整体观
- 烧伤湿润暴露疗法的中西医结合
EXIPERIMENTAL RESEADRCH ON THE MECHANISM OF THE EFFECT OF MEBO
山东 滨州医学院微生物学教研室(256603) 曲云英 王运平 邱世翠
李波清 亢国英 陈金荣
刘希琴 刘同慎 付志强
[内容摘要] 用小鼠胸腺细胞 MTT比色法检测了MEBO对小鼠皮肤组织细胞产生白细胞介素-1的影响.实验表明,MEBO对局部皮肤组织细胞白细胞介素-1的产生水平的增强作用,与对照组相比P<0.01.通过行为测痛法观察到MEBO可以提高家兔对饱和KCI溶液(
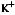 )电极刺痛的痛阈,与凡士林组相比有明显差异,尤以9min差异更为显著,P<0.01.实验进一步表明了细菌在含有一定浓度MEBO的环境中对不同菌株不同种类的细菌形态变异的特点和出现的时间是有差异的.实验结果显示,MEBO能提高局部皮肤组织细胞产生白细胞介素-1的水平和能促进小鼠皮肤基底层细胞分裂与促进创面愈合的减轻疤痕形成有密切关系.MEBO具有抗感染和止痛作用.
)电极刺痛的痛阈,与凡士林组相比有明显差异,尤以9min差异更为显著,P<0.01.实验进一步表明了细菌在含有一定浓度MEBO的环境中对不同菌株不同种类的细菌形态变异的特点和出现的时间是有差异的.实验结果显示,MEBO能提高局部皮肤组织细胞产生白细胞介素-1的水平和能促进小鼠皮肤基底层细胞分裂与促进创面愈合的减轻疤痕形成有密切关系.MEBO具有抗感染和止痛作用. 关键词:MEBO IL-1 痛阈 细菌变异
MEBO在烧伤创疡的治疗中疗效是显著的.由于MEBO的药物成份、剂型及与机体相互作用所产生的生物效应是多方面的,所以其作用机理是复杂的.本实验研究进一步控讨了MEBO在促进创面愈合、减轻疤痕形成、抗感染和止痕等方面的作用机理,为MEBO的临床应用进一步提供理论依据.
一、材料和方法
(一)主要仪器和试剂
全自动酶标仪MULTISKAN MS 、AC-920血液分析仪、WQ-9E痛阈测痛仪、湿润烧伤膏MEBO、RPMI-1640 GIBCO USA 、ConA 广州医卫所生产、MTT FLUKA 公司产品、致病性大肠杆菌
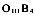 滨医附院检验科提供.
滨医附院检验科提供. (二)实验动物分组及方法
BALB/C小鼠(北医动物管理中心提供)32只(8周龄,雌性),体重17~19g.昆明小鼠28只,(雌雄不拘),体重21~24kg.家兔18只,体重2~2.5kg.豚鼠4只,体重250~300g.以上动物由本院动物室提供.
以上动物分别分为:I组为对照组,II组为MEBO试验组.试验组在小鼠背部约2×2cm无毛区涂抹MEBO,在豚鼠背部约3×2.5cm无毛区涂抹MEBO,每d二次,第9d进行白细胞介素-1(interleukin,IL-1)活性检测、HE染色观察组织学变化.
(三)检测指标
1.致病性大肠杆菌
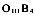 形态变异:
形态变异: 在含一定浓度MEBO培养基上进行传代,按法[1]每代进行Gram`s染色,观察其染色反应和形态变异,并与普通大肠杆菌在一定浓度MEBO培养基上的形态变异特点进行比较.
2.IL-1的检测:
用MTT比色法检测IL-1的水平是以MTT为底物,利用活细胞具有活性的琥珀酸脱氢酶,使黄色的MTT还原产生紫色或兰色的甲臜颗粒(formazam),加入盐酸异丙醇溶解其颗粒,测出OD值.被还原甲臜的量同存活的细胞数成正比[2].按法[3]测定,但在试验用量上相应增加.在无菌条件下处死小鼠,取胸腺剪碎过筛,离心制成细胞浓度为1×
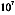 /ml的细胞悬液内含Con A2ug/ml,加入24孔板中0.5ml孔,再分别将待检的对照和试验组小鼠的皮肤组织悬液和血浆加入24孔板中0.5ml孔,并设1640营养液对照组(胸腺细胞加营养液)和有丝分裂原对照组(ConA加胸腺细胞).将24孔板置5%C
/ml的细胞悬液内含Con A2ug/ml,加入24孔板中0.5ml孔,再分别将待检的对照和试验组小鼠的皮肤组织悬液和血浆加入24孔板中0.5ml孔,并设1640营养液对照组(胸腺细胞加营养液)和有丝分裂原对照组(ConA加胸腺细胞).将24孔板置5%C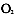 37`C孵箱中孵育68h,每孔吸出上清0.5ml弃去,2然后每孔加5ug/ml的MTT0.1ml.在上述条件下再培养4h.然后,每孔加入酸化异丙醇溶液0.5ml,振动使其完全溶解,再各取上清加入96孔板0.2ml/孔,置全自动酶标仪测定其OD值,以反映皮肤组织细胞及血浆IL-1水平(测定波长为560nm).
37`C孵箱中孵育68h,每孔吸出上清0.5ml弃去,2然后每孔加5ug/ml的MTT0.1ml.在上述条件下再培养4h.然后,每孔加入酸化异丙醇溶液0.5ml,振动使其完全溶解,再各取上清加入96孔板0.2ml/孔,置全自动酶标仪测定其OD值,以反映皮肤组织细胞及血浆IL-1水平(测定波长为560nm). 3.MEBO对家兔体温的影响:
在家兔皮肤涂抹MEBO前测其体温,然后,每d在其背部6×6.5cm无毛区涂抹MEBO二次,每d在同一时间测量体温一次,共6次,观察体温变化.
4.MEBO对小鼠血液中白细胞分类的影响:
分别对试验组,对照组小鼠摘眼球取血0.2ml加入10ml试剂液中,于AC-920血液分析仪进行检测.
5.MEBO对家兔痛阈的影响:
在家兔足背部无毛区(3×2.5cm)以饱和KCI溶液电极刺痛,用痛阈测痛仪检测,以家兔开始出现撤腿反射为痛阈指标(基础痛阈),然后,在家兔足背部无毛区涂抹MEBO,在其涂沫MEBO的边缘或在其足背部无毛区涂MEBO的中央(用酒精擦去MEBO大小约1.3×1.3cm)滴加饱和KCI溶液电极刺痛,每隔3min测一次痛阈.另一组家兔涂抹凡士林,方法同上.测其实验前后痛阈变化.
6.定量溶血分光光度测定法(QHS):
此法[4]通过分光光度法测定抗体形成细胞介导的溶血反应中SRBC溶解后释放血红蛋白量来反映免疫小鼠抗体形成细胞量的变化(OD值表示)以反映机体的体液免疫功能.
7.a—醋酸萘酯酶(ANAE)测定法:
分别取对照组、试验组小鼠尾血制成薄的血片.按法[5]进行酸性酯酶染色,镜检100个淋巴细胞.凡在淋巴细胞浆内见到单一或散在(1~3个)红色点块为ANAE阳性细胞,求ANAE阳性细胞百分率,可反映机体细胞免疫功能.
8.小鼠皮肤涂抹MEBO后的组织学变化: 取正常小鼠和涂抹MEBO的小鼠背部无毛区皮肤约0.5
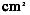 ,立即固定,包埋,HE染色,观察组织学变化.
,立即固定,包埋,HE染色,观察组织学变化. 二、结 果
(一)MEBO的抗感染作用:
1.MEBO对大肠杆菌与致病性大肠杆菌形态变异的比较(见表1)

从表1可以看出细菌生长在含有一定浓度MEBO的环境中不论是烧伤感染常见细菌还是致病性大肠杆菌都可引起细菌形态的变异.但MEBO对不同种类的细菌在形态变异出现的时间上有明显差异.
2.MEBO对循环血白细胞分类的影响(见表2)
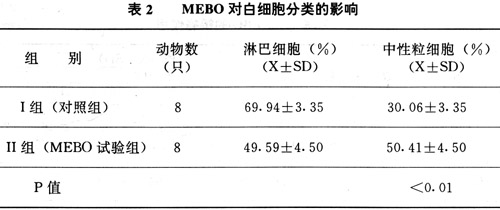
表2所示MEBO可使血流中的中性粒细胞数量增多,P<0.01. 3.MEBO对家兔体温的影响(见表3)
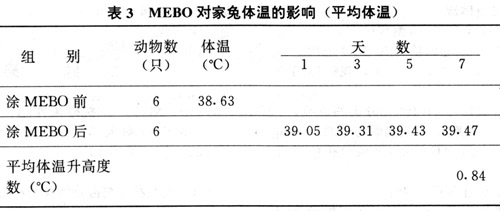
实验显示MEBO使75%的家兔体温升高.涂MEBO第7天平均体温比涂MEBO前升高0.84`C.
(二)MEBO对创伤愈合和减少疤痕形成的影响:
1.MEBO对小鼠皮肤组织细胞IL-1产生的影响(见表4)
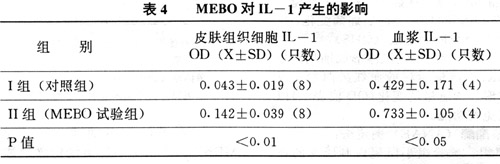
从表4所见MEBO可诱导皮肤产生IL-1的细胞合成IL-1.IL-1可促进胸腺细胞的增殖反应并与ConA分裂原有协同作用.MEBO试验驵皮肤组织细胞中IL-1水平与对照组相比,P<0.01,血浆中IL-1水平与对照组相比,P<0.05. 2.MEBO可促进皮肤细胞和皮脂腺边缘细胞增生活跃. 从实验中可见到皮肤基底细胞分裂相增多,皮脂腺边缘细胞呈扁平状的幼稚细胞多,表明细胞代谢旺盛.
(三)MEBO对家兔痛阈的影响(见表5):
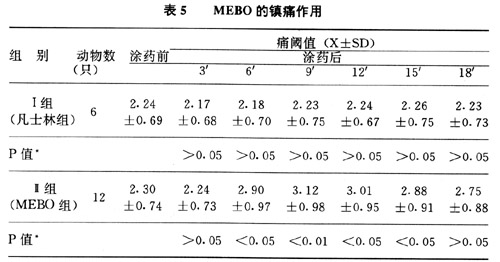
从表5中可见到MEBO可提高家兔痛阈,尤以涂MEBO后第9min痛阈最高,与涂药前相比,P<0.01.凡士林对家兔痛阈影响涂药前后相比P>0.05.
(四)MEBO对小鼠特异性免疫功能的影响(见表6)
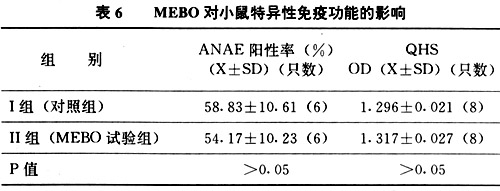
从表6可见MEBO的应用不影响机体的细胞免疫和体液免疫功能.
三、讨 论
MEBO湿润烧伤膏药物广泛的临床应用,疗效显著,有力地证明了MEBO具有抗感染、止痛、促进创面愈合和减轻疤痕形成等作用[6].我们就以下几方面进行实验研究进一步探讨了MEBO的作用机理.
(一)MEBO的抗感染作用:
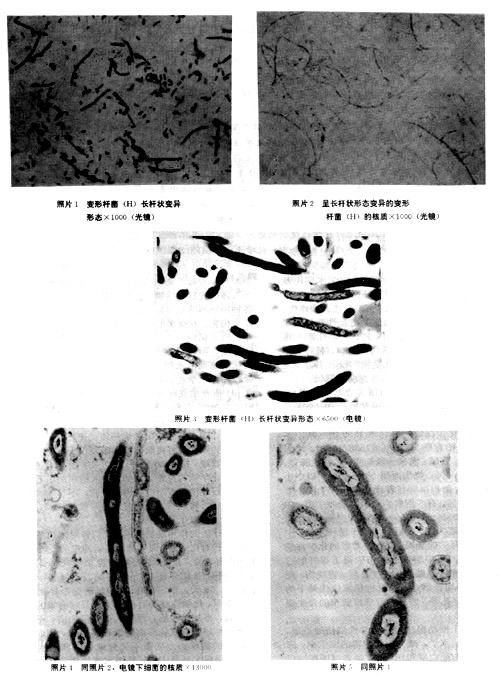
1.MEBO具有明显的控制烧伤创面感染的作用.MEBT所用的MEBO能保持创面湿润而不浸渍.MEB为中所含的药物成份及剂型造成了不利于细菌生长繁殖的环境.从实验结果看出,在含有一定浓度的MEBO的培养基上,一些细菌出现了形态结构及生理上的变异.如变形杆菌由中等大小杆菌到呈长杆状或长丝状,继续传代培养又出现了形态基本正常的杆菌,但菌体出现明显着色深的颗粒.此现象说明了MEBO的药物成份及剂型使细菌 生长繁殖速度,继而影响了DNA合成速度而导致细菌生长繁殖速度减慢.另外,在几种细菌如大肠菌、变形杆菌和绿脓杆菌等都能在菌体内见到着色深的颗粒.这与在一定浓度MEBO培养基上细菌繁殖速度处于相当于细菌生长繁殖曲线的稳定期,而在此期间菌体内可储藏较高水平的糖原、脂类等有关[7].见变形杆菌照片1、2(光镜),3、4、5(电镜).
从实验中观察到MEBO对几种细菌都可引起形态和生理等方面的变异,如对绿脓杆菌色素及金葡菌血浆凝固酶量的产生的影响.细菌的致病性的降低,但同一种细菌在含不同浓度的MEBO培养基上或者不同细菌在含有同一浓度的MEBO培养基上所引起形态异的特点和变异出现的时间是有差异的.
2.MEBO在治疗烧伤病人时发现早期体温较传统疗法高1~1.5`C浅II度创面使用MEBO后约3小时体温开始上升[8].从表3中可见,家兔皮肤涂抹MEBO后体温出现有上升现象.涂抹MEBO第7天与用药前相比,家兔体温平均升高0.84`C.从表4可见MEBO可诱导皮肤产生IL-1的细胞如表皮细胞、皮肤角质细胞和郎罕氏细胞等产生IL-1.早在40年代人们就发现,把来自急性炎症反应区的组织提出物注射给兔或人可导致发热.将提出的发热物质称为内源性致热源(EP).1979年首次报告纯化的EP具有IL-1的活性,将EP与IL-1视为同一分子[9].MEBO可以刺激局部皮肤细胞产生IL-1经吸入血流作用体温调节中枢而使肌体体温升高.
发热对哺乳动物的机体抵抗力有何影响,至今资料和观点尚不统一.部分学者的研究表明,体温适度升高,对提高宿主的免疫防御能力是有利的.在温度升高的情况下,对单核巨噬功能影响的研究资料虽存在有一些相互矛盾之处,但总体说来,在一定范围内(<41`C)的温度升高,大部分吞噬细胞吞噬功能是增强的[10].我们的实验研究观察到MEBO可提高小鼠腹腔Mφ吞噬功能[1].从表2中可见,动物经皮肤涂抹MEBO后,可使血液中中性粒细胞数量明显增多,这可能与IL-1对骨髓的刺激作用有关.
(二)MEBO可促进创伤愈合,减轻疤痕形成:
许多临床资料表明,病人深II度以下创面愈合后多为上皮化愈合,深II度以上和III度创面即使疤痕愈合也较平软.我们在动物实验中观察到,涂抹MEBO的试验组小鼠皮肤及皮下组织在MEBO的作用下可诱导皮肤产生IL-1的细胞产生IL-1与对照组相比有显著差异.IL-1的产生除M 以外,机体还有多种组织来源的细胞可在受到刺激情况下产生IL-1.一般情况下,细胞在受到刺激后1小时即可测到细胞外IL-1活性[9].IL-1、IL-8、TNF是一组主要由单核巨噬细胞,内皮细胞产生的细胞因子,具有激活,诱导T、B细胞分化,增强单核细胞、NK细胞、杀伤靶细胞,趋化并激活中性粒细胞,促进中性粒细胞的溶酶体酶活性和吞噬功能.
近年来无论动物实验还是人类的临床实验结果都说明IL-1能引起一系列病理生理学变化.这些变化与宿主对感染的应答非常相似[11],表明IL-1是机体炎症和免疫反应的重要调节因子.在认识这个问题时,必须将IL-1的局部作用与IL-1的全身血循环的高水平的后果相区别,也就是在这两种情况下有很大差异[11].从表4可见到涂抹MEBO的小鼠皮肤和皮下组织细胞外的IL-1含量与对照组相比有显著差异(P<0.01).而试验组血浆IL-1含量与对照组相比P<0.05.IL-1与创伤愈合有密切关系.临床观察表明,在局部创伤渗出液中含有IL-1.另一方面,IL-1可促进纤维细胞增殖及促进分泌胶原酶[11].IL-1的作用是复杂的,它可引起炎症和发热,同时又可促进创面愈合,IL-1引起的炎症反应被认为是机体的防御反应[12]
从实验中可看到,涂抹MEBO的小鼠皮肤基底细胞分裂相增多,可见到皮脂腺腺泡周围的幼稚细胞活跃.这些现象说明了MEBO可促进创伤愈合速度.
(三)MEBO的止痛作用:
MEBO具有止痛作用.从表5可见到MEBO可提高试验组家兔的痛阈.在第9分钟与对照组相比P<0.01.与凡士林组相比P<0.05.虽然MEBO与凡士林涂抹创面都有隔绝空气减少刺激等作用,但用饱和KCI溶液电极刺痛家兔足背部时,凡士林组却不能提高家兔痛阈,而MEBO组能提高家兔痛阈,以9分钟时最为显著.这可能与MEBO药物成份对感染N末梢的保护作用有关,从而降低了神经末梢对外来刺激的敏感性.也可能与局蜕药物成份被吸收后在皮肤、皮下组织细胞表面形成一层药物保护层阻止外界刺激因素对细胞膜的作用有关,从而减少了细胞内化学介质如K 等致痛物质的释放对神经末梢伤害性感受器的刺激作用而达到止痛作用.也可能是在MEBO的作用下干扰了伤害性感受器神经细胞释放某种致痛物质,从而发挥了镇痛作用.
(四)MEBO对特异性免疫功能的影响:
从表6可见,MEBO的应用可使血流中性粒细胞增多,但淋巴细胞的减少是相对的.从表7所示,MEBO的作用不影响机体的细胞免疫功能与体液免疫功能.
综上实验表明,MEBO具有抗感染、止痛、促进创面愈合和减轻疤痕形成等作用
参 考 文 献
[1]曲云英,等.中国烧伤创疡杂志 1996年;1:19
[2]Mosmann.T.J Immanol Methods 1983;65:55
[3]郑永唐,等.免疫学杂志 1992年;3(4)267
[4]毕爱华.医学免疫学 同济医科大学出版社 1986;7
[5]吴景兰,等.免疫学快报 1983:(2):27
[6]徐荣祥.中国烧伤创疡杂志 1993;4:20
[7]余 贺主编.医学微生物学 1?83;54
[8]徐荣祥.中国烧伤创疡杂志 1992;(4)3
[9]杨贵贞主编.免疫生物工程纲要与技术 吉林科学出版社 1991;2~6 11~ 15
[10]Roterts NJ.Rew Infect Dis 1991:13:452
[11]陈文杰主编.血液分子细胞生物学 中国医卫科技出版社 1993;126~ 127,362
[12]杨贵贞等.基因工程与临床免疫学进展 国内外医学科学进展 上海市医科技术情报研究所1987.P124